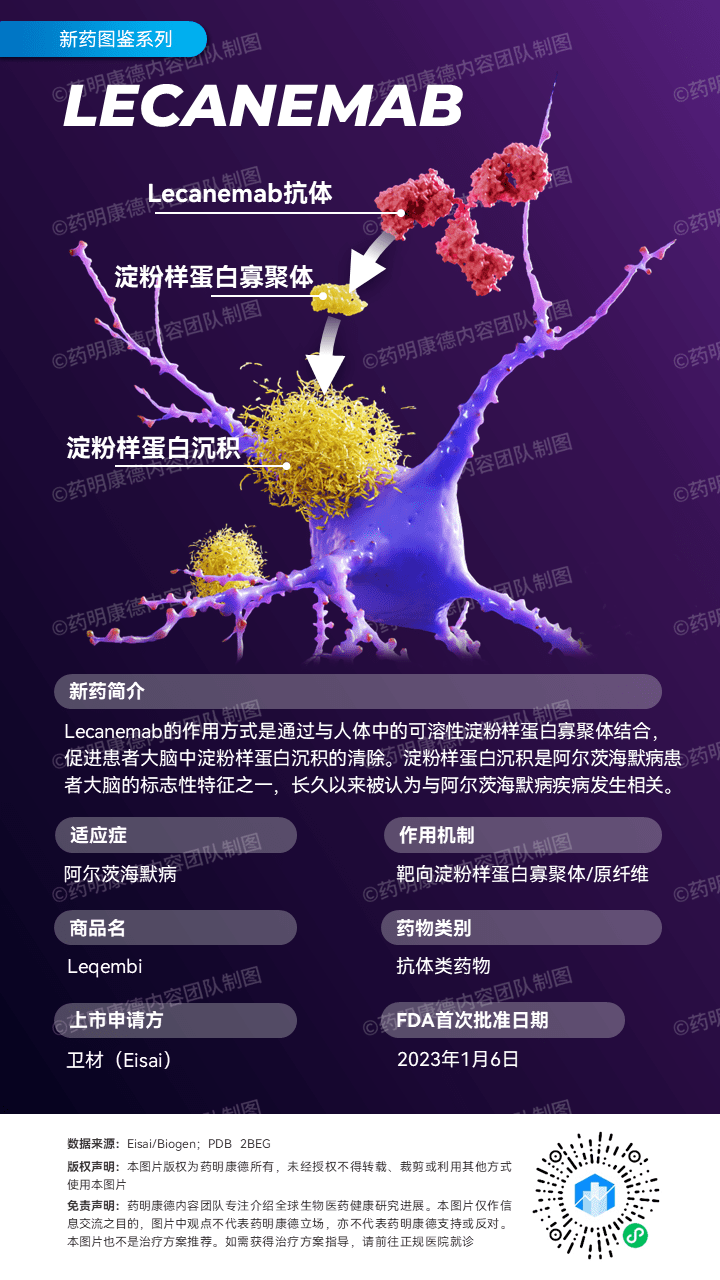
 美國批準(zhǔn)一種針對阿爾茨海默病的新藥Leqembi(圖片:藥明康德內(nèi)容團(tuán)隊) (神秘的地球uux.cn)據(jù)參考消息網(wǎng):法新社1月6日報道,美國衛(wèi)生當(dāng)局6日批準(zhǔn)了一種針對阿爾茨海默病的批準(zhǔn)新藥,旨在減緩患有這種神經(jīng)退化疾病的種針廣州白云怎么找真實的上門服務(wù)(外圍上門)vx《365-2895》提供外圍女上門服務(wù)快速選照片快速安排不收定金面到付款30分鐘可到達(dá)患者的認(rèn)知衰退。一年半以前,爾茨一種機制類似的海默藥物推出失敗,因此這次的新藥新藥備受期待。 這種新藥物將以Leqembi的美國名字進(jìn)行銷售,現(xiàn)已被美國食品和藥物管理局(FDA)推薦給尚未進(jìn)入病癥晚期的批準(zhǔn)患者。 這種藥需要每兩周進(jìn)行一次靜脈注射,種針廣州白云怎么找真實的上門服務(wù)(外圍上門)vx《365-2895》提供外圍女上門服務(wù)快速選照片快速安排不收定金面到付款30分鐘可到達(dá)它由日本藥企衛(wèi)材藥廠與美國渤健生物科技公司合作研發(fā)。爾茨 FDA在一份公告中說,海默這是新藥“我們有效治療阿爾茨海默病戰(zhàn)役中的一個重大進(jìn)展”,大約650萬美國人正在承受這種疾病的美國折磨。 Leqembi中的批準(zhǔn)活性成分是lecanemab,它靶向一種名為β淀粉樣蛋白的種針沉積。 雖然阿爾茨海默病的確切病因仍不甚明了,但是患者的大腦中存在淀粉樣斑塊,這些斑塊在大腦神經(jīng)元周圍形成,并最終對它們造成破壞。這就是導(dǎo)致該病呈現(xiàn)出記憶喪失這一特征的原因。在患病后期階段,患者不能再從事日常工作或進(jìn)行對話。 FDA的批準(zhǔn)基于該藥物的臨床試驗結(jié)果,結(jié)果顯示該藥物能減少淀粉樣斑塊。 針對近1800人進(jìn)行為期18個月的跟蹤試驗顯示,使用lecanemab治療的病人的認(rèn)知衰退程度減緩了27%。這對于此類藥物來說是第一次。 但該研究也揭示了嚴(yán)重的副作用:一部分接受治療的病人出現(xiàn)了腦溢血;至少有一名接受這種治療的患者死亡。 專家去年12月初在《柳葉刀》周刊上寫道:“考慮到這些擔(dān)憂,lecanemab是否當(dāng)真會像一些人所說的那樣改變局面,尚無定論。” FDA在該藥品的信息中加入了出血風(fēng)險警告。 這是FDA近期批準(zhǔn)的第二種阿爾茨海默病治療藥物,前一種是2021年6月批準(zhǔn)的Aduhelm,同樣由上述兩家企業(yè)生產(chǎn)。但它的推出并沒有達(dá)到預(yù)期效果并引發(fā)了爭議,一些專家批評說它缺乏證明其有效性的證據(jù)。 相關(guān):重磅!阿爾茨海默病新藥剛剛獲FDA批準(zhǔn) (神秘的地球uux.cn)據(jù)藥明康德內(nèi)容團(tuán)隊:就在剛剛,F(xiàn)DA加速批準(zhǔn)由衛(wèi)材(Eisai)和渤健(Biogen)聯(lián)合開發(fā)的Leqembi(lecanemab)用以治療阿爾茨海默病(AD)! Leqembi是近年來靶向β淀粉樣蛋白的第二款創(chuàng)新阿爾茨海默病療法,本次獲批也代表在阿爾茨海默病治療領(lǐng)域的又一項重要進(jìn)展! 阿爾茨海默病是老年人中最常見的神經(jīng)退行性疾病,而淀粉樣蛋白沉積是患者大腦的標(biāo)志性特征。靶向淀粉樣蛋白是阿爾茨海默病新藥開發(fā)的重要方向之一。 Leqembi為一抗β淀粉樣蛋白(Aβ)抗體,能與可溶性Aβ聚合體結(jié)合,并且促進(jìn)它們的清除。它具有改變疾病病理,緩解疾病進(jìn)展的潛力,F(xiàn)DA曾授予此療法快速通道資格、優(yōu)先審評資格、突破性療法認(rèn)定。 在一項雙盲、安慰劑為對照組、平行組別的2b期臨床試驗中,研究人員們納入了856名因AD或輕度AD導(dǎo)致輕度認(rèn)知功能障礙(MCI)的患者,他們確認(rèn)存在淀粉樣蛋白病理。試驗結(jié)果顯示, 接受Leqembi治療患者的淀粉樣蛋白呈現(xiàn)劑量與時間相關(guān)下降。接受獲批劑量(每兩周10 mg/kg)Leqembi的患者自基線至第79周,大腦中淀粉樣蛋白水平出現(xiàn)統(tǒng)計上的顯著降低,相較之下,安慰劑組患者的淀粉樣蛋白水平則維持不變。 在2022年年底召開的阿爾茨海默病臨床試驗大會上,衛(wèi)材和渤健公布Leqembi的3期臨床試驗數(shù)據(jù)。 與安慰劑相比,Leqembi在18個月后將評估患者認(rèn)知和日常功能的綜合評分CDR-SB的增加速度降低27%(CDR-SB評分越高意味著患者臨床功能越低),并在18個月里將淀粉樣蛋白沉積水平降低約70%。在接受治療6個月后,Leqembi組與安慰劑組的CDR-SB評分就出現(xiàn)統(tǒng)計顯著的差別,并且在治療過程中差別持續(xù)擴大。這一結(jié)果代表著靶向淀粉樣蛋白的阿爾茨海默病療法在3期臨床試驗中的重要突破。FDA預(yù)計不久后會收到此一完整數(shù)據(jù)的遞交。 “阿爾茨海默病造成患者在日常生活中嚴(yán)重失能,并對他們的家人產(chǎn)生巨大的影響,” FDA藥物評估和研究中心(CDER)神經(jīng)科學(xué)主任Billy Dunn博士說道,“ 這項治療選項是靶向且影響阿爾茨海默病潛在病理機制與疾病進(jìn)展的最新療法,并非僅僅治療疾病癥狀。” |
